国家卫健委刚刚发布的《医疗机构新冠病毒核酸检测工作手册(试行第二版)》中在“性能验证”和“其他要求”部分均提出了建议选用高灵敏核酸检测试剂(检测限≤500拷贝/mL)的要求。


事实上先前多个技术规范和工作通知中均已明确提出类似建议(选择灵敏度高的检测试剂)[1-3],但此文件中是第一次明确指出高灵敏检测试剂检出限临界数值为500拷贝/mL。对于目前国家药品监督管理局(NMPA)已批准的新冠病毒RT-PCR法检测试剂而言,大部分试剂说明书中宣称的检测灵敏度是可以满足此要求的,见表1。
表1 十五种试剂盒的宣称检测限
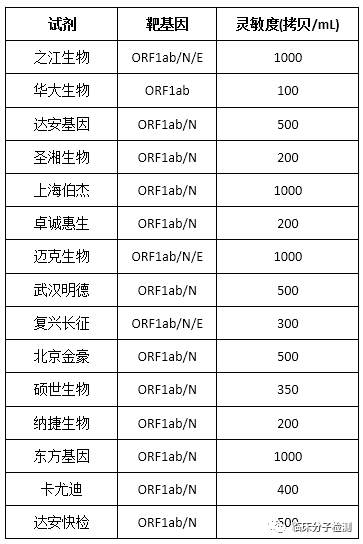
但是对于少量试剂来说,其说明书中所宣称的灵敏度无法满足此要求,这个文件出台让他们挺被动,这不立马有厂商声明已完成试剂检出限变更注册,也有几位老师私下问我该怎么办?那么暂且先不管这个问题。我们先来想想,这些试剂宣称的检出限就是其真实检出限吗?先前我们对NMPA首批批准的6种RT-PCR试剂最低检测限的比较结果表明并非如此[4]。而目前NMPA已经批准了十几种试剂,其中大部分试剂已在临床广泛应用,那么它们实际检出限之间是否存在差异?目前也没看到这些数据,正好11月份我们做过相关评估,借此机会把评估结果简单介绍一下,以供各位感兴趣的同行参考。
样本:新冠病毒核糖核酸基因组标准物质(编号:GBW(E)091099)购自中国计量院,其为纯化后的人源核糖核酸基因组, ORF1ab、N 和E基因拷贝数浓度分别为6.89×105、1.36×106、8.04×105拷贝/mL(数字PCR定值)。方法:将标准物质(以ORF1ab基因浓度为准)2倍倍比稀释,参考试剂盒最低检测限制备若干梯度浓度样品,每浓度重复20次检测,48h内完成所有检测,结果判定以厂家说明书中要求为准,以具有95%阳性检出率的最低浓度水平作为试剂盒的最低检测限。
实验结果:
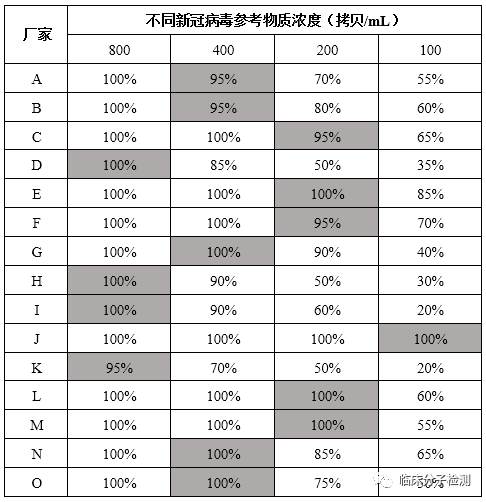
注:为避免产生误解,检测结果中厂家均以字母代替,且顺序和表1中并不相同,请大家勿对号入座。
实验结论:
- 不同厂家试剂实际检测限间存在差异(最大8倍),其中最低100拷贝/mL,最高800拷贝/mL(以中国计量院标准物质的ORF1ab基因定值结果为准)。
不同厂家所宣称检出限与其实际检出限并不一致,约70%厂家试剂真实检出限符合或超出其宣称检出限。
上述结论可以回答先前所提问题,就是试剂间真实检出限确实存在差异,且试剂宣称检出限可能与其真实检出限有较大不同。因此,建议实验室选择试剂前应先选取几种试剂进行比较,选取性能最为优良的一种用于后续检测。当然,实验室也应对所选试剂进行性能验证,且须由本实验室操作人员完成。此外,对于本次实验未达到500拷贝/mL要求的部分试剂,其差异也可能并非试剂本身所致,而是由于试剂批间差原因造成(本次评估每种试剂仅使用同一批次)。因此,建议大家严格按照相关要求进行试剂批间差验证,尽可能保证检测试剂性能良好,以保证检测结果准确可靠。
参考文献
[1]中华人民共和国国家卫生健康委员会 (2020-07-22) 关于印发新冠病毒核酸筛查稀释混样检测技术指引的通知.
[2]中华人民共和国国家卫生健康委员会(2020-08-19) 关于印发新冠病毒核酸10合1混采检测技术规范的通知.
[3]中华人民共和国国家卫生健康委员会(2020-11-09) 关于加强外送样本新冠病毒核酸检测质量管理工作的通知.
[4]Wang X, Yao H, Xu X, et al. Limits of Detection of Six Approved RT-PCR Kits for the Novel SARS-coronavirus-2(SARS-CoV-2). 2020,Clin Chem 66 (7):977-979.




